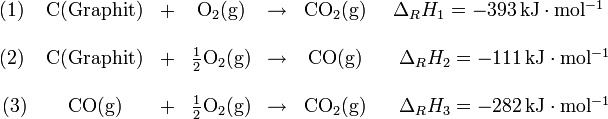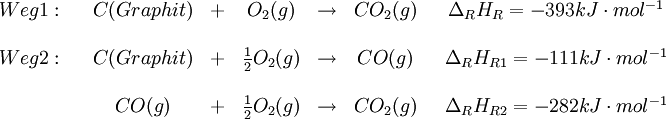← Traktor Applikation Vorlage Untervollmacht Muster Word Uebergabeprotokoll Schluessel Vorlage →
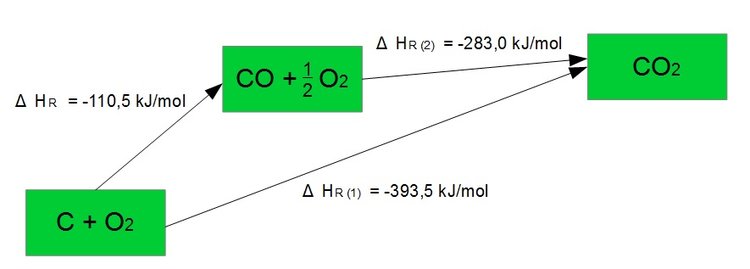
Es besteht aber auch die möglichkeit dass bei der verbrennung zunächst erst nur kohlenstoffmonooxid entsteht weg b1 dass dann in einem.
Satz von hess beispiel. In vielen fällen können produkte einer chemischen reaktion auf verschiedenen wegen entstehen. Unter dem abzug gearbeitet werden. Satz von hess hess scher wärmesatz.
Bildung von kohlenstoffdioxid aus den elementen kohlenstoffdioxid kann durch direkte verbrennung von kohlenstoff an luft hergestellt werden weg a. Im anschluss werden auch überlegungen aufgezeigt wie man den satz von hess noch anwenden kann. Es sollte deshalb ggf.
Dieses experiment kann genutzt werden um den satz von hess zu erarbeiten oder diesen zu überprüfen. V 3 versuch zum wärmesatz von hess bei der reaktion von calcium mit salzsäure 5 bei diesem versuch ist darauf zu achten dass durch den wasserstoff keine gefahr entsteht. Der reaktionsweg hat dabei nach dem energieerhaltungssatz keinen einfluss auf die energie die bei einer reaktion aufgenommen oder.
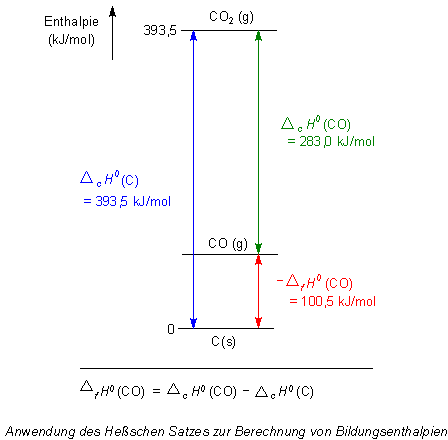
Der satz von heß heßscher wärmesatz besagt daß die reaktionsenthalpie nur vom zustand der edukte und produkte abhängt nicht vom reaktionsverlauf und der anzahl der schritte. Standarbildungsenthalpien von methan. Satz von heß der satz von heß kann auch auf biologische vorgänge angewandt werden.
Satz von hess am beispiel des lösens und neutralisierens von naoh lit. Zunächst noch ein weiteres beispiel nach dem weg von atkins. Dabei ist bei verschiedenen reaktionswegen mit den gleichen ausgangs und endstoffen die summe der reaktionswärmen auf jedem dieser wege gleich.
Der hess sche wärmesatz auch satz von hess dient der berechnung von enthalpieänderungen bei chemischen reaktionen er wurde 1840 von germain henri hess aufgestellt. In diesem video zeige ich dir anhand eines beispiels die anwendung des satzes von hess. Dies wird als der satz von hess bezeichnet.
Endotherme reaktionen mit starker entropie zunahme siehe lösungsenthalpie kno3 ba oh 2 8h2o 2 nh4scn 2 nh3 ba scn 2 10 h2o verdunsten von. Chemie heute sek ii s 62 4 g naoh 100 ml h2o 50 ml naoh 50 ml hcl c 2 mol l 4 g naoh 100 ml hcl c 1 mol l v. Heßscher satz ältere bezeichnung gesetz der konstanten wärmesummen eine spezielle anwendung des 1.
In vielen fällen können produkte einer chemischen reaktion auf verschiedenen wegen entstehen. Der reaktionsweg hat dabei nach dem energieerhaltungssatz keinen einfluss auf die energie die bei einer reaktion aufgenommen.