← Vorvertrag Grundstueckskauf Muster Vorlage Beurteilung Mitarbeiter Widerspruch Gegen Inobhutnahme Muster →
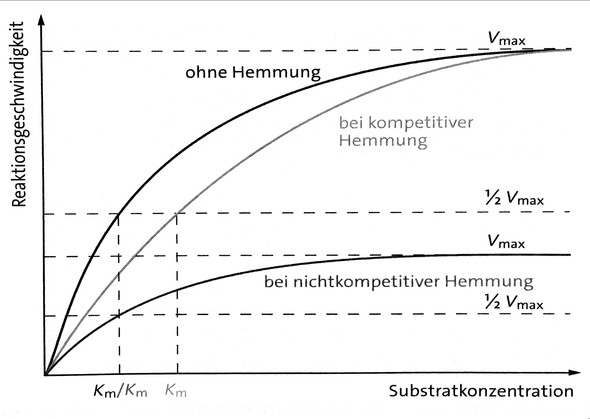
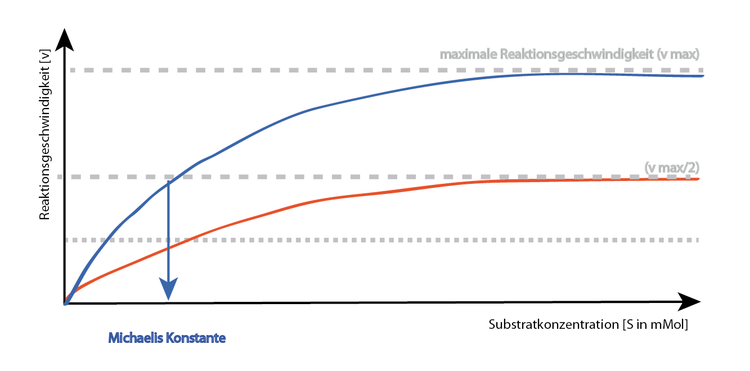
Allosterische hemmung nicht kompetitive hemmung einen nicht kompetitiven reversiblen inhibitor erkennt man daran dass er die maximalgeschwindigkeit v max der enzymreaktion herabsetzt.
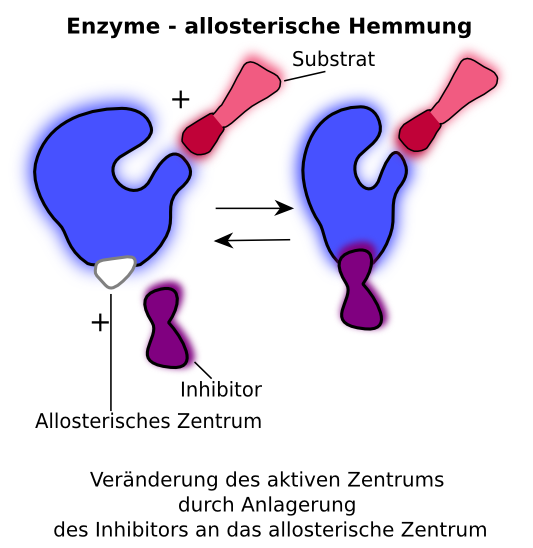
Allosterische hemmung beispiel. Ein allosterischer inhibitor blockiert einen teil des enzyms dabei ändert sich die konformation und das enzym kann nicht weiter arbeiten ist also blockiert. Stereos starr fest bedeutet dass das enzym eine weitere bindungsstelle besitzt an der ein anderer stoff binden kann. Jedoch bindet bei der nicht kompetitiven hemmung beispielsweise ein schwermetallion an das aktive zentrum was meinen erkenntnissen nach bei der allosterischen hemmung nicht passiert.
Dieser beeinflusst die form konformation der katalytischen bindungsstelle so dass das enzym gehemmt oder in vielen fällen auch gefördert wird. Was eine allosterische hemmung ist weiß ich soweit. Das ganze passiert im körper um enzyme zu regulieren wenn es sonst zum beispiel zu einer anhäufung von produkten käme.
Ein beispiel für eine irreversible hemmung sind die sogenannten suizid substrate die mit der funktionellen gruppe des enzyms eine kovalente bindung eingehen und dieses somit blockieren. Erhöhung der substratkonzentration kann den inhibitor aber nicht daran hindern auch an. Ein allosterischer inhibitor bindet im extra vorgesehenen allosterischen zentrum des enzyms reversibel also nicht dauerhaft.
Die bindung hat eine änderung der konformation zur folge die die funktion des enzym teilweise oder gänzlich blockiert. Ein beispiel für eine irreversible hemmung sind die sogenannten suizid substrate die mit der funktionellen gruppe des enzyms eine kovalente bindung eingehen und dieses somit blockieren. Allosterische hemmung nicht kompetitive hemmung bei der allosterischen hemmung oder auch nicht kompetitive hemmung binden sich inhibitoren an das allosterische zentrum eines enzyms und reduzieren auf diese weise seine aktivität.
Ich selbst bin beim lernen jedoch auch noch auf die allosterische hemmung gestoßen bei der ein inhibitor an das allosterische zentrum bindet wodurch die passform des aktiven zentrums des enzyms verändert wird. Ein beispiel für eine irreversible hemmung sind die sogenannten suizid substrate die mit der funktionellen gruppe des enzyms eine kovalente bindung eingehen und dieses somit blockieren. Die allosterische enzymhemmung ist der nichtkompetitive hemmung sehr ähnlich.
Er setzt einen teil der enzyme durch seine bindung außer gefecht.